
Hva kan et legemiddel
Mysimba® (naltrexon/ bupropion) er en medikamentell behandling mot fedme som gjennom sine to komponenter, påvirker sultsenteret og belønningssystemet i hjernen. (1-3)
Mysimba er et varemerke registrert av Nalpropion Pharmaceuticals LCC. © 2020 Nalpropion Pharmaceuticals LCC. EU/1/14/988. MYS-0179-002, 06/21 For mer informasjon, kontakt Navamedic ASA, Tlf: 67112540, E-post: infono@navamedic.com, www.navamedic.com
Retningslinjer for individuell refusjon av Mysimba
ICD-10: E66 / ICPC-2: T82 Fedme
- BMI ≥ 35 og < 40 med en vektrelatert tilleggssykdom eller en tilleggslidelse/-sykdom som øker risikoen for alvorlig fedmerelatert sykdom.
- BMI ≥ 40
Informasjon om relaterte diagnoser for tilleggssykdom finner du på www.helsedirektoratet.no
Vedlegg 1 til § 5-14 legemiddellisten (under Mysimba).
Søknaden sendes elektronisk via e-reseptløsningen eller via Helsedirektoratets portal: https://portal.helsedirektoratet.no
NB! Du må være koblet til Norsk Helsenett (NHN) for at lenken skal være aktiv.
Refusjon av Mysimba innvilges umiddelbart dersom kriteriene er oppfylt.

En kombinasjon av to velkjente substanser
Naltrekson er en mu-opioidreseptorantagonist. Bupropion er en selektiv nevronal reopptakshemmer av noradrenalin og dopamin. Begge substansene har veldokumenterte sikkerhetsprofiler og har blitt brukt i behandling av alkoholisme, depresjon og røykeavvenning med opp til 30 års erfaring. (1)
▼ Dette legemidlet er underlagt særlig overvåking. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning til Statens legemiddelverk. Meldeskjema ligger på www.legemiddelverket.no/meldeskjema.
Virkningsmekanisme
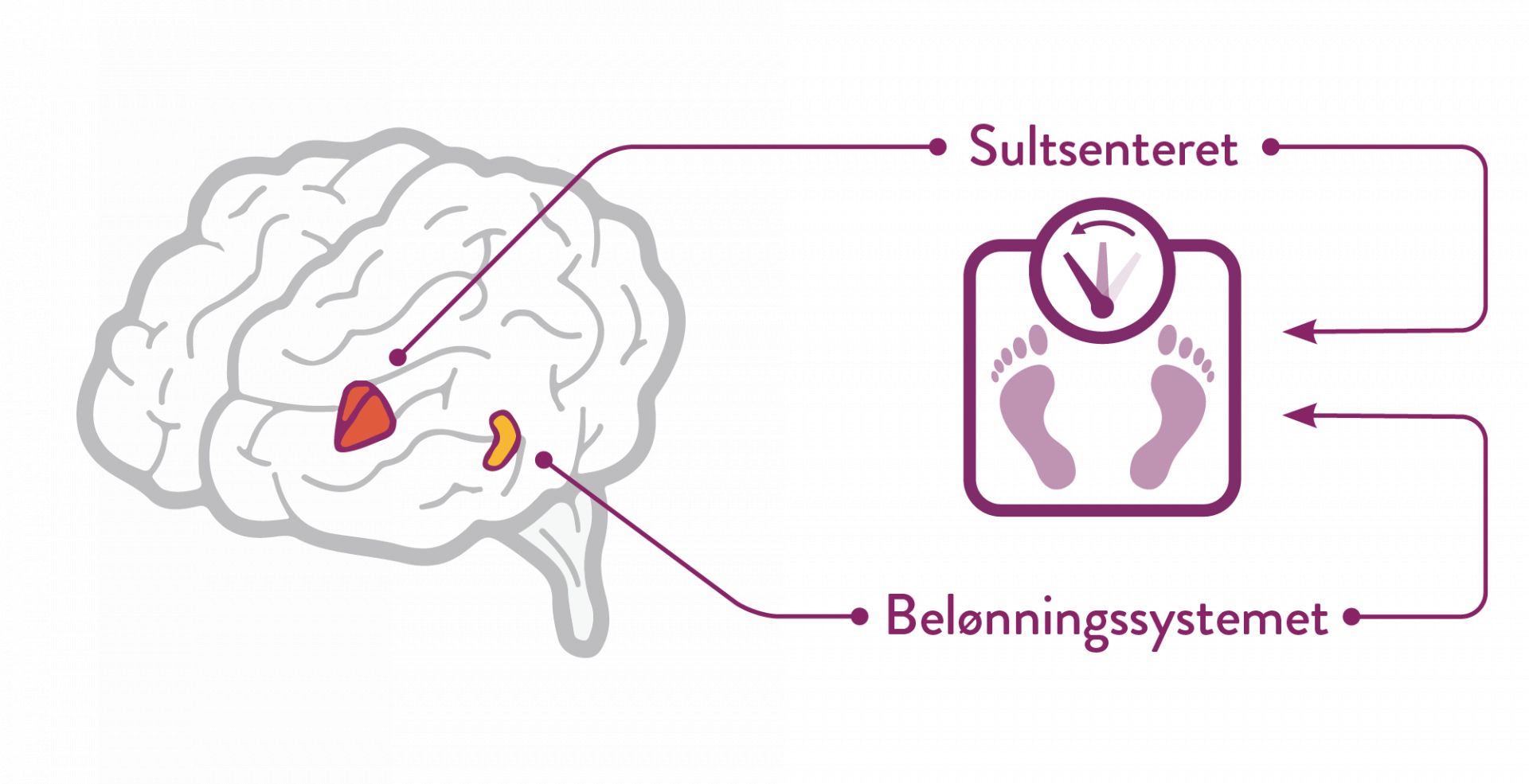
Mysimba påvirker hovedsakelig to områder i hjernen; arkuatuskjernen i hypotalamus (sultsenteret) og det mesolimbiske dopaminerge belønningssystemet (ventrale tegmentumområdet, accumbenskjernen og prefrontal korteks). (1)*
Bupropion stimulerer POMC†-nevron i hypotalamus som anses å ha betydning for appetittregulering og energibalanse. Ved stimulering av POMC-nevron frigjøres et melanocyttstimulerende hormon (α-MSH), som deretter binder sammen og stimulerer melakortinreseptorer (MC4-R). stimuleringen fører til redusert appetitt og økt energiforbruk og følgelig en vektreduksjon. (1)
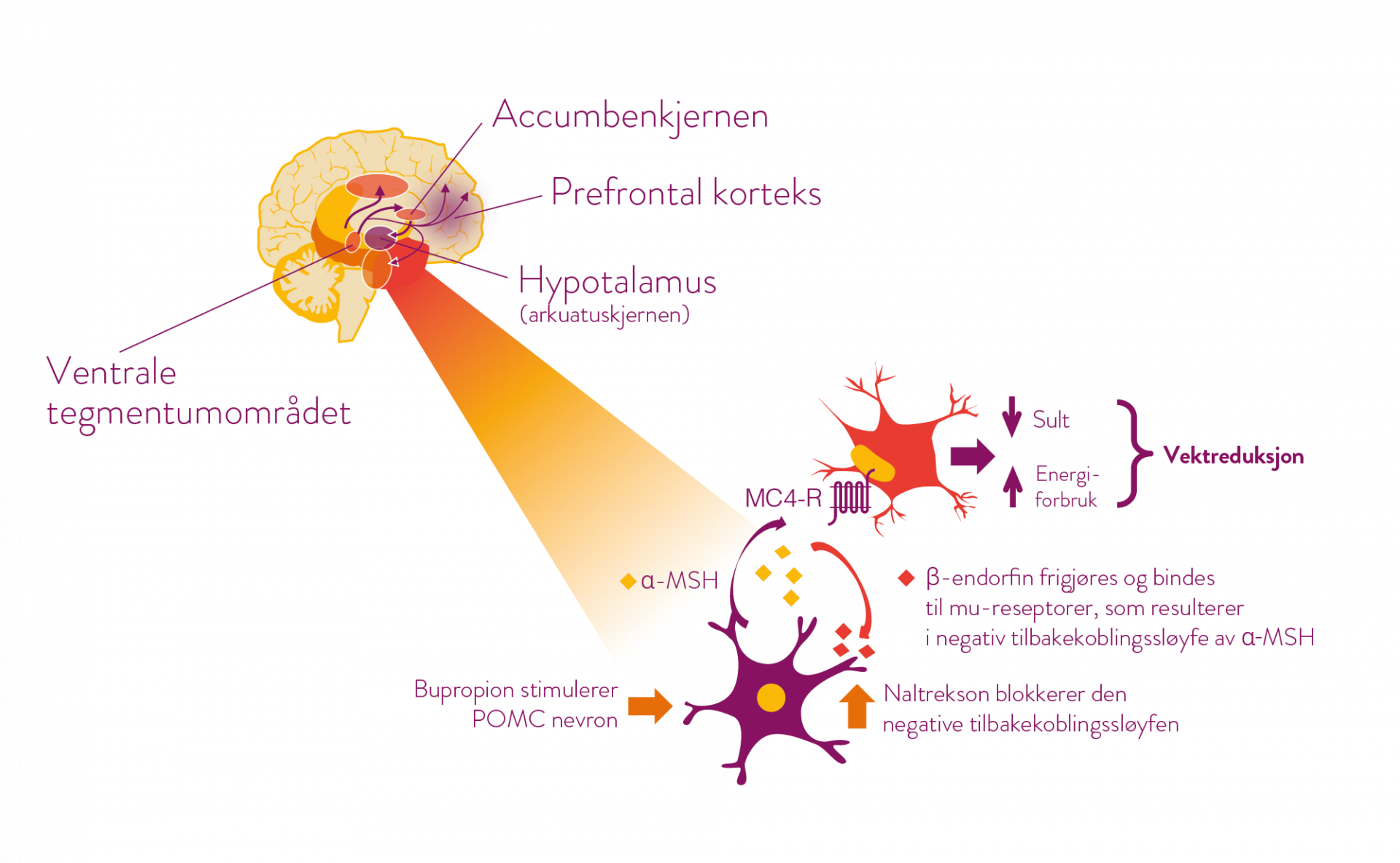
Når α-MSH frigjøres foregår det samtidig en frigjøring av β-endorfin fra POMC-nevronen som bindes til mu-opioide reseptorer på samme nevron. Bindingen resulterer i en negativ tilbakekoplingsløyfe, som fører til redusert frigjøring av α-MSH. Naltrekson blokkerer denne negative tilbakekoplingsløyfen og derved forsterkes og forlenges bupropions effekter i sultsenteret.
* Den eksakte nevrokjemiske appetittdempende effekten a naltrekson/bupropion er enda ikke helt klarlagt.
† Proopiomelanokortin

Hvilke pasienter er aktuelle for behandling med Mysimba?
Mysimba skal brukes som tillegg til kalorifattig kosthold og økt fysisk aktivitet for vektreduksjon hos voksne (≥18 år) med innledende kroppsmasseindeks (BMI) på ≥30 kg/m2 (fedme) eller ≥27-30 kg/m2 (overvekt) samt én eller flere vektrelaterte risikofaktorer (f.eks. diabetes type 2, dyslipidemi eller kontrollert hypertensjon). (1)
Behandlingen bør seponeres etter 16 uker hvis pasienten ikke har mistet minst 5% av innledende kroppsvekt. (5)
Mysimba respondere og ikke respondere (5)
Det kliniske testprogrammet har vist at 51% av pasientene kan forventes å få et vekttap på minst 5% etter 16 ukers behandling. Disse pasientene kategoriseres som Myimba-respondere. Vekttapsterskelen på >5% i uke 16 hadde 86,4% positiv prediktiv verdi og 84,8% negativ prediktiv verdi for å bestemme om et individ behandlet med Mysimba ville oppnå minst 5% vekttap i uke 56. De pasientene som ikke oppnådde målet i uke 16, ble ansett som ikke-respondere. (5)
Nylig publisert studie om fenotyper (10)
Årsaken til at en person utvikler fedme avhenger ev en rekke bioliogiske og atferdsmessige (9) faktorer, hvor såkalt følelsesstyrt spising (emotional hunger) er en vanlig årsak *
Lær mer om faktorene bak en vellykket vekttapsbehandling. Få tilgang til resultatene fra Acosta-studien (10) her.
*Følelsesstyrt spising er preget av et ønske om å spise for å takle positive eller negative følelser.

Legens kontrolliste for forskrivning
For å sikre riktig valg av pasienter for behandling med Mysimba, oppfordres det til å fylle ut følgende kontrolliste:
Tydelige resultat, vedvarende vektreduksjon (1, 6-9)
Mysimba er undersøkt i fire randomiserte, dobbeltblinde, placebokontrollerte 56-ukers studier med totalt 4 536 pasienter. (1, 6-9)

Signifikant vektreduksjon i forhold til placebo (5)
I samtlige kliniske studier ble det oppnådd en vesentlig vektreduksjon, i kombinasjon med kost- og aktivitetsrådgivning, fra basislinjen ved uke 4 og som ble opprettholdt under etterfølgende 4 ukers oppfølgingsintervaller frem til studiene avsluttet. (5)
I tillegg til vekttap ble det observert statistisk signifikante forbedringer i triglyserider og HDL-kolesterol sammenlignet med placebo i samtlige fire fase 3-studiene. (6-9)
51% av alle pasienter reduserer sin initiale vekt med minst 5% etter 16 ukers behandling (5)
Det kliniske testprogrammet har vist at 51% av pasientene kan forventes å få et vekttap på minst 5% etter 16 ukers behandling. Disse pasientene kategoriseres som Mysimba-respondere. (5)
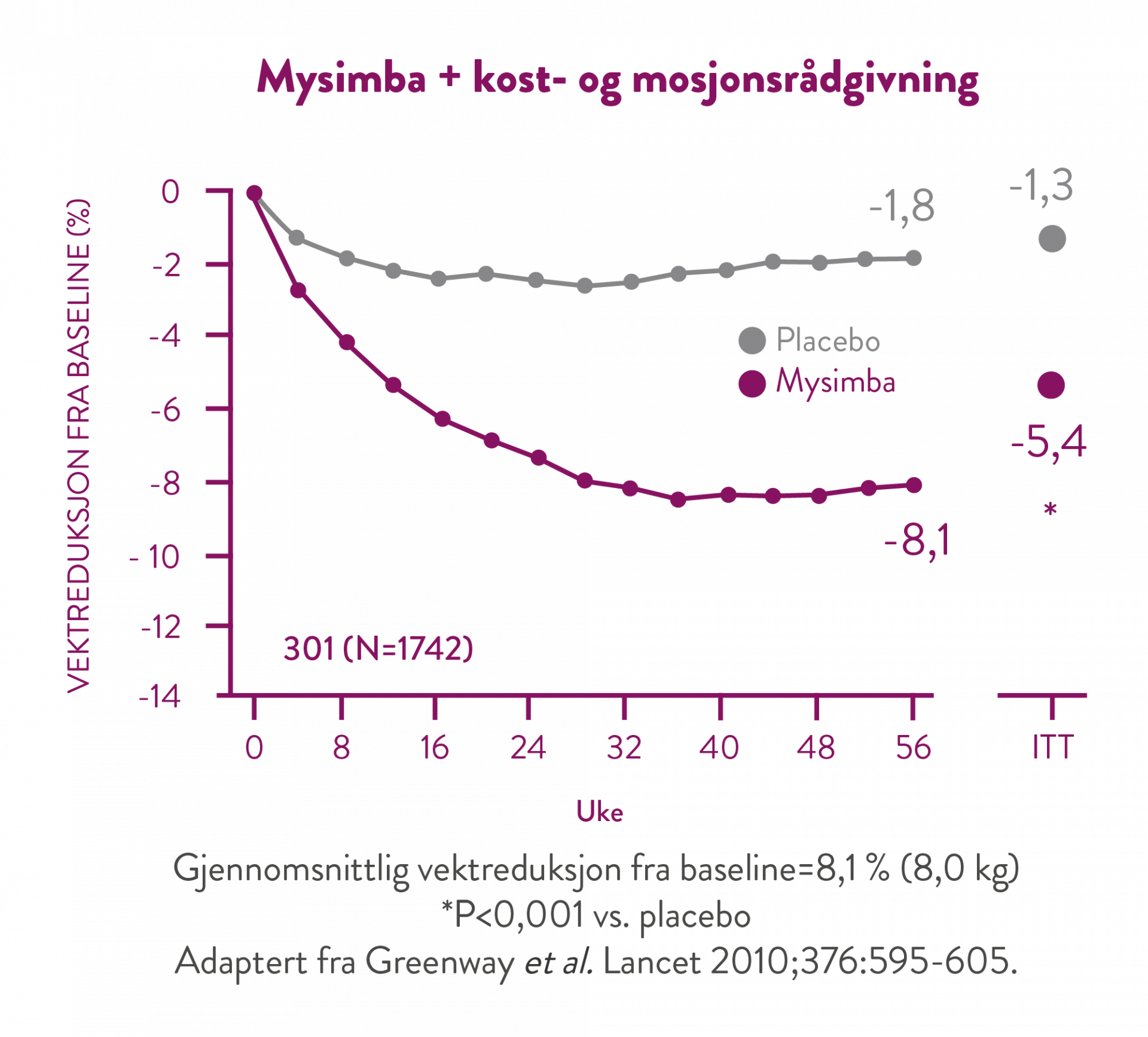
I denne studien fikk samtlige pasienter individuell rådgivning om redusert kaloriinntak og økt fysisk aktivitet (30 minutter hver dag). (7)
Etter 56 ukers behandling har de pasientene som oppnådde 5% vekttap etter 16 uker, et gjennomsnittlig vekttap på 11,3%. (5)
Behandling med Mysimba skal avbrytes etter 16 uker dersom pasienten ikke har mistet minst 5% av sin innledende kroppsvekt. (1, 5)
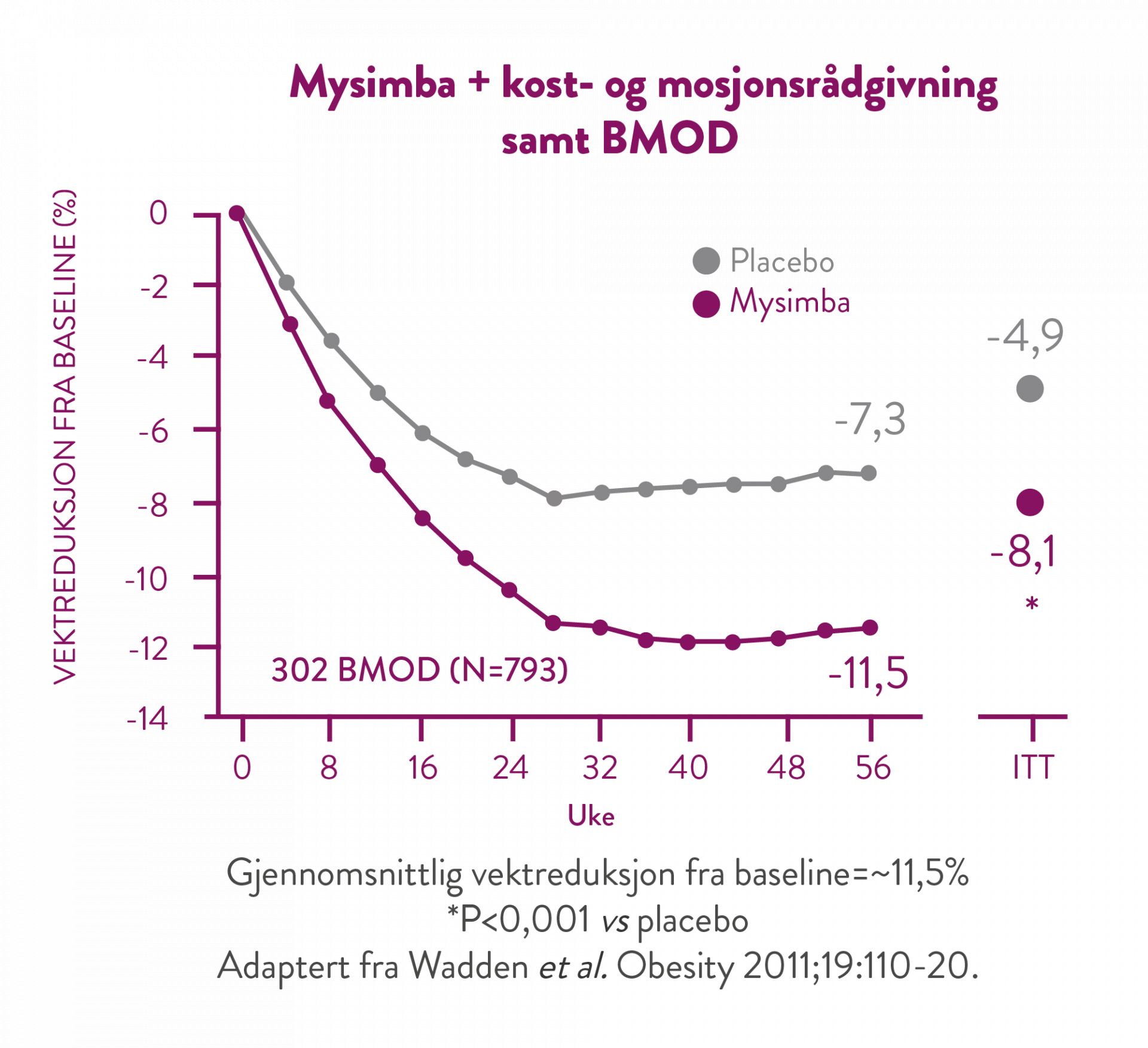
I denne studien fikk pasientene ta del i et intensivt adferdsendringsprogram (BMOD, behavior modification) bestående av 28 gruppeterapi sesjoner i løpet av 56 uker, samt et strengt diett- og aktivitetsregime. (9)
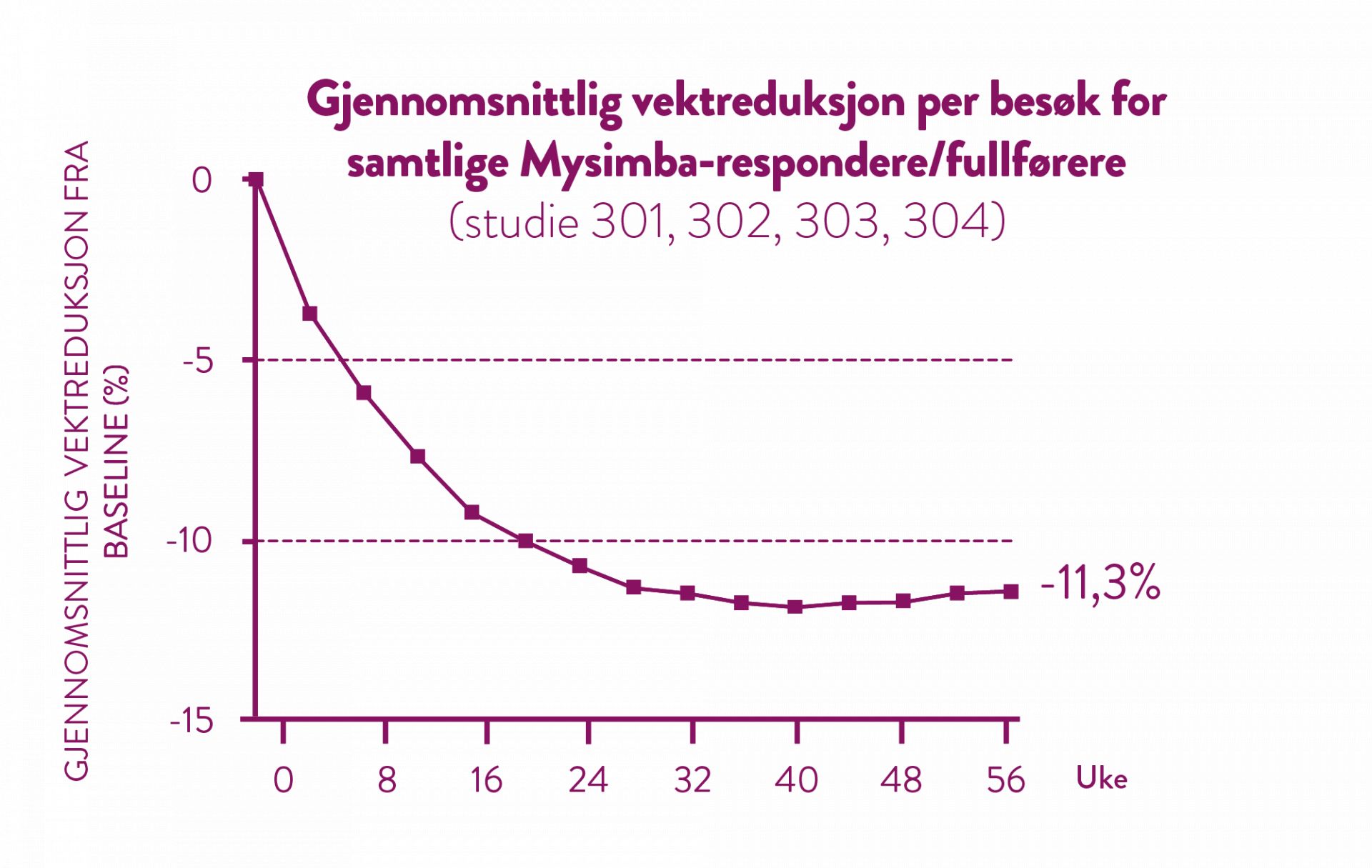
Andelen pasienter som oppnådde minst 5% vektrediksjon etter 16 uker var 51% = responders.
Mysimba respondere og ikke respondere (5)
En annen effekt av Mysiba var at HbA1c ble signifikant redusert hos de pasientene med type 2-diabetes som fikk behandling med Mysimba, sammenlignet med placebo. (8) Mysimba har ingen godkjent indikasjon for behandling av type 2-diabetes.
Toleranse og sikkerhet
Mysimbas sikkerhetsprofil er dokumentert i flere dobbeltblinde, placebokontrollerte studier. (1, 6-9)

For å sikre riktig valg av pasienter for behandling med Mysimba, skal en kontrolliste for forskrivning fylles ut.
Dosering og administrering
Mysimba er en depottablett som skal svelges hel sammen med vann, og inntas i samband med måltid. Tabletten må ikke deles, tygges eller knuses. (1)
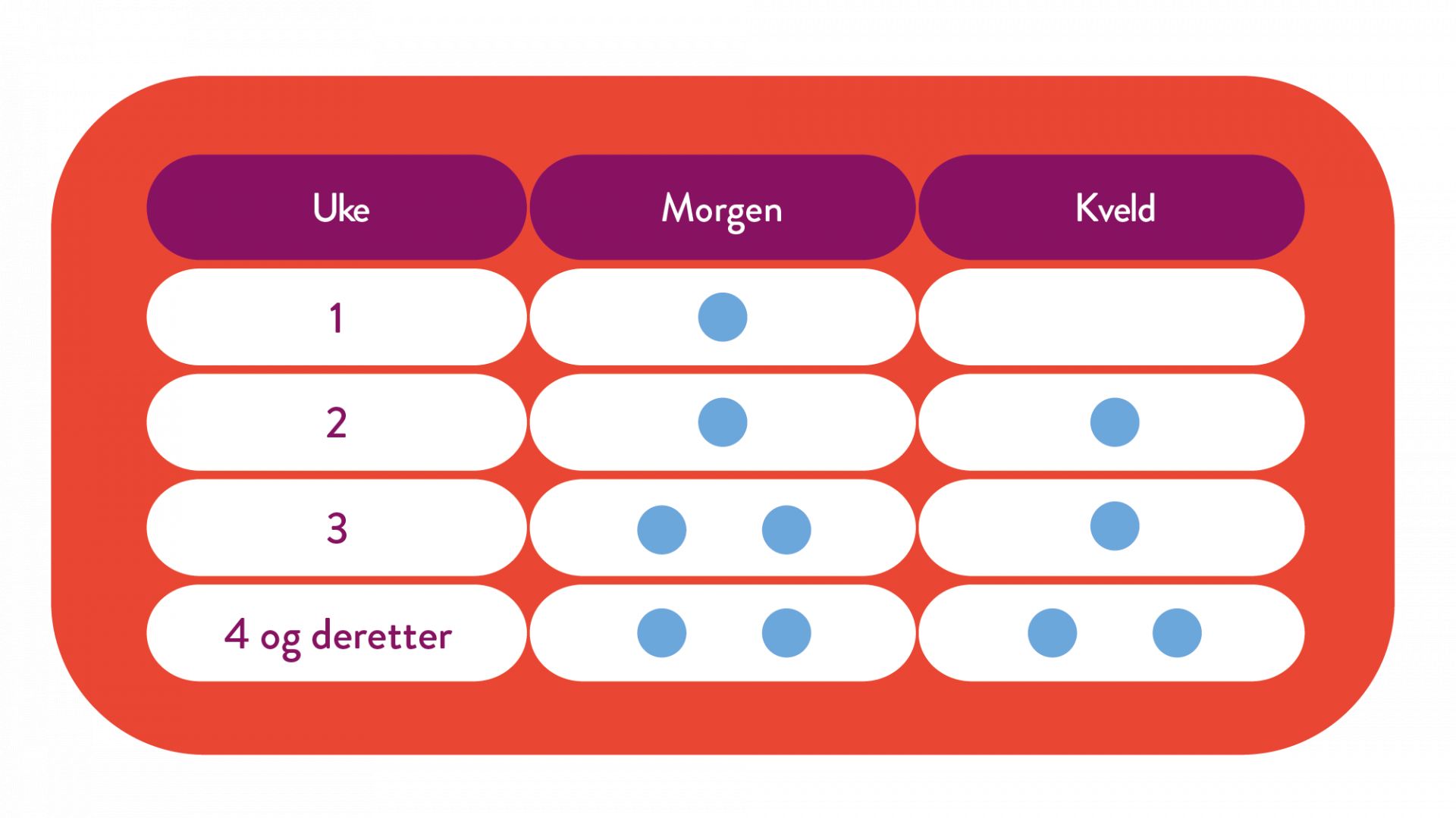
Mysimba dosetitreres inntil maksimal dose på 2 tabletter 2 ganger per dag. Dosetitreringen foregår i løpet av en 4-ukersperiode i henhold til følgende skjema: (1)
Behovet for fortsatt behandling skal vurderes etter 16 uker og deretter vurderes på nytt hvert år. Behandling med Mysimba skal avbrytes etter 16 uker om pasienten ikke har mistet minst 5% av sin initiale kroppsvekt.
Om pasienten glemmer en dose skal pasienten ikke ta en ytterligere dose, men ta neste ordinerte dose til vanlig tid.
Hver tablett inneholder 8 mg naltreksonhydroklorid og 90 mg bupropionhydroklorid. Største anbefalte døgndose av Mysimba er to tabletter to ganger per dag til en total dose på 32 mg naltreksonhydroklorid og 360 mg bupropionhydroklorid. (1)
Oppfølging
Tidlig og kontinuerlig oppfølging/kontakt med pasienter under behandling av fedme er viktig og anbefales i henhold til flere retningslinjer for overvekt og fedme. (1)
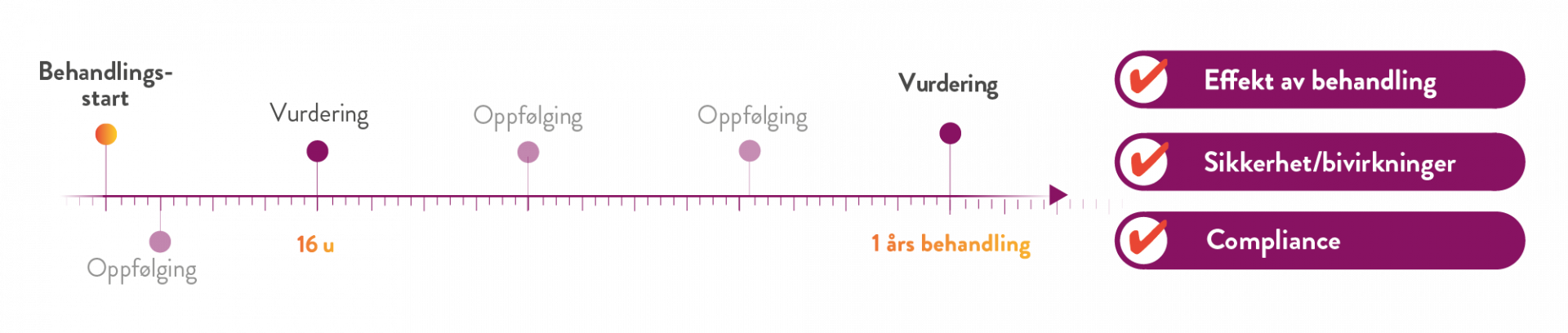
Tidslinjen illustrerer de besøk som kreves for oppfølging av pasienter som får Mysimba som del av sin behandling. Det finnes dog store individuelle forskjeller i hvor ofte hver enkelt pasient trenger oppfølging og støtte.
Referanser
- Mysimba Preparatomtale, jan 2025.
- Greenway FL. Physiological adaptions to weight loss and factors favouring weight regain. International Journal of Obesity 2015;39: 1188-96.
- Müller MJ, et al. Changes in energy expenditure with weight gain and weight loss in humans. Current Obesity Reports 2016;5:413-23.
- Sumithran P, et al. Long-term persistence of hormonal adaptions to weight loss. New England Journal of Medicine 2011;365:1597-1604.
- Fujioka K, et al. The relationship between early weight loss and weight loss at 1 year with naltrexone ER/bupropion ER combination therapy. Int J Obesity 2016;40:1369-75.
- Apovian CM, et al. A randomized, phase 3 trial of naltrexone SR/bupropion SR on weight and obesity related risk factors (COR-II). Obesity 2013;21:935-43.
- Greenway FL, et al. Effect of naltrexone plus bupropion on weight loss in overweight and obese adults (COR-I): a multicenter, randomized, double-blind, placebo-controlled, phase 3 trial. Lancet 2010;376:595-605.
- Hollander P, et al. Effects of naltrexone sustained-release/bupropion sustained-release combination therapy on body weight and glycemic parameters in overweight and obese patients with type 2 diabetes. Diabetes Care 2013;36:4022-9.
- Wadden TA, et al. Weight loss with naltrexone SR/bupropion SR combination therapy as an adjunct to behavior modification: the OR-BMOD
- Yumuk V, et al. European Guidelines for Obestity Management in Adults, Obes Facts 2015;8:402-24).
- Acosta A, et al. Selection of Antiobesity Medications Based on Phenotypes Enhances Weight Loss: A Pragmatic Trial in an Obesity Clinic. Obesity 2021; 29 (4): 662–671.
EU/1/14/988
Utdrag fra Felleskatalogtekst
▼Dette legemidlet er underlagt særlig overvåking. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning til Statens legemiddelverk. Meldeskjema ligger på www.legemiddelverket.no/meldeskjema
Mysimba «naltrekson og bupropion» depottablett
Reseptgruppe C
Indikasjoner: Indisert som tillegg til et kalorifattig kosthold og økt fysisk aktivitet for vektreduksjon hos voksne ≥18 år med en innledende kroppsmasseindeks (BMI/KMI) på
≥ 30 kg/m2 (fedme) eller
≥ 27 kg/m2 til 30 kg/m2 (overvekt)
samt én eller flere vektrelaterte risikofaktorer (f.eks. type 2 diabetes, dyslipidemi eller kontrollert hypertensjon).
Bør seponeres etter 16 uker hvis ikke vekttap ≥5% av innledende kroppsvekt.
Dosering: Ved oppstart bør dosen økes i en 4-ukers periode som følgende: Uke 1: 1 tablett morgen. Uke 2: 1 tablett morgen og kveld. Uke 3: 2 tabletter morgen og 1 tablett kveld. Uke 4 og videre: 2 tabletter morgen og kveld. Maks. anbefalt døgndose er 2 tabletter morgen og kveld. Behov for videre behandling bør vurderes etter 16 uker og revurderes årlig. Kardiovaskulær risiko ved bruk av Mysimba utover ett år, er ikke fullstendig fastslått. Behandling med Mysimba skal avsluttes etter ett år dersom pasienten ikke har opprettholdt et vekttap på minst 5 % av sin innledende kroppsvekt. Årlig vurdering skal utføres av helsepersonell i samråd med pasienten dersom videre behandling vurderes. Se pakningsvedlegg og SPC for spesielle pasientgrupper.
Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Ukontrollert hypertensjon. Nåværende/tidligere krampeanfall. Kjent tumor i CNS. Pågående akutt avvenning fra alkohol eller benzodiazepiner. Tidligere bipolar lidelse. Samtidig bruk av bupropion eller naltrekson. Eksisterende eller tidligere diagnostisert bulimi eller anoreksi. Avhengighet av opioider, opioidagonister brukt ved opioidavhengighet eller pågående akutt opioidavvenning. Samtidig behandling med MAO-hemmere (minst 14 dager fra seponering av MAO-hemmer til oppstart av Mysimba). Alvorlig nedsatt leverfunksjon. Terminal nyresvikt.
Forsiktighetsregler: Selvmordhendelser inkl. selvmordstanker er sett, og nøye overvåkning, særlig de med høy risiko, bør komme i tillegg ved behandling, spesielt ved oppstart og doseendringer. Pasienter/omsorgspersoner bør varsles om å observere evt. klinisk forverring, selvmordrelatert atferd eller tanker og uvanlige forandringer i atferd og søke umiddelbar hjelp ved slike symptomer. Bupropion er forbundet med en dose-relatert risiko for anfall. Skal seponeres ved anfall under behandling. Se også kontraindikasjoner og SPC for predisponerende faktorer som kan øke risikoen for anfall. Alkoholinntak bør reduseres til minimum eller unngås under behandling. Pasienter skal advares mot samtidig bruk av opioider. Kan brukes med forsiktighet etter at opioidbruk er avsluttet i minst 7 til 10 dager Bør seponeres midlertidig i minst 3 dager ved behov for intermitterende opiatbehandling, og opiatdosen må ikke økes over standarddose. Forsøk på å overvinne opioidblokade av naltrekson ved inntak av store doser opioider er svært farlig og kan medføre dødelig overdosering eller livstruende opioidforgiftning (f.eks. respirasjonsstans, sirkulatorisk kollaps). Pasienter må være oppmerksomme på potensiell økt følsomhet overfor lave doser opioider etter seponering av Mysimba. Anafylaktisk reaksjon ved symptomer som pruritus, urtikaria, angioødem og dyspné som krever medisinsk behandling, i tillegg til spontanrapporter om erythema multiforme og anafylaktisk sjokk er sett ved bupropion, og pasienter bør avslutte behandling og oppsøke lege ved allergiske eller anafylaksilignende eller anafylaktiske reaksjoner. Artralgi, myalgi og feber med utslett og andre symptomer som tyder på forsinket overfølsomhet er sett med bupropion. Pasienter bør rådes å kontakte behandlende lege ved slike symptomer, samt seponere ved mistanke om serumsyke. Alvorlige hudbivirkninger (SCARs) som Stevens-Johnsons syndrom (SJS) og akutt generalisert eksantematøs pustulose (AGEP, som kan være livstruende/dødelig er sett. Pasienter bør informeres om tegn/symptomer og overvåkes for hudreaksjoner, samt seponere umiddelbart ved tegn/symptomer på slike reaksjoner. Skal ikke gjenopptas dersom SJS eller AGEP oppstår under behandling. Serotonergt syndrom er sett ved samtidig bruk av serotonergt legemiddel og opioider. Pasienter må bes om å utøve forsiktighet ved bilkjøring og bruk av maskiner, spesielt under oppstart og doseendringer.
Interaksjoner: Se interaksjonsanalyse på Felleskatalogen for fullstendig informasjon.
Graviditet, amming og fertilitet: Graviditet: Ingen/begrenset data. Bør ikke brukes under graviditet eller av fertile kvinner som forsøker å bli gravide. Amming: Naltrekson/bupropion og deres metabolitter skilles ut i morsmelk. Bør ikke brukes under amming, da risiko for diende barn ikke kan utelukkes pga. begrenset data. Fertilitet: Ingen humane data.
Bivirkninger: Svært vanlige: Hodepine, kvalme, forstoppelse, oppkast. Vanlige: Angst, somnolens, tremor, vertigo, økt blodtrykk, munntørrhet, abdominalsmerter, utslett. Sjeldne: Angioødem, anfall (kramper), legemiddelindusert leverskade, brystsmerter.
Overdosering/Forgiftning: Ingen erfaring ved kombinert bruk av bupropion og naltrekson. Symptomer: Bupropion: Anfall, hallusinasjoner, bevisstløshet, sinustakykardi og/eller EKG-forandringer som ledningsforstyrrelser (inkl. QRS-forlengelse) og arytmier. Feber, muskelrigiditet, rabdomyolyse, hypotensjon, stupor, koma og respirasjonssvikt er sett i kombinasjon med andre legemidler. Dødsfall er sett. Naltrekson: Begrenset data. Behandling: Sikre frie luftveier, oksygenering og ventilasjon. Hjerterytme og vitale tegn bør overvåkes. EKG-overvåkning anbefales de første 48 timene etter inntak. Generelle støttetiltak og symptombehandling. Aktivt kull bør gis. Sykehusinnleggelse bør vurderes etter mistanke om overdosering, pga. dose-relatert risiko for anfall av bupropion.
For mer informasjon, se Felleskatalogteksten eller preparatomtalen (SPC)
Innehaver av markedsføringstillatelsen: Orexigen Therapeutics, Irland.
Kontaktinformasjon: Telefon: 67112540 E-post: infono@navamedic.com
Basert på SPC godkjent av DMP/EMA: 05.2025
Pakninger og priser per 04.06.2025: 112 stk. (blister) 1245,40 kr. (priser og ev. refusjon oppdateres hver 14. dag).
Utarbeidet 06/2025
Mysimba er et varemerke registrert av Nalpropion Pharmaceuticals LCC. © 2020.
MYS-0347-001 06/24